【热点提升】无机化工流程题的破解策略(可下载word版)
- 2026-03-04 00:39:43

对于资料下载,敬请点击:
【友情提示】本公众号使用说明书
热点精讲
1.培养从试题提供的新信息中,准确地提取实质性内容,并与已有知识块整合,重组为新知识块的能力。
2.培养将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力。
3.培养将分析和解决问题的过程及成果,用正确的化学术语及文字、图表、模型、图形等表达,并做出解释的能力。
一、工业流程题的结构
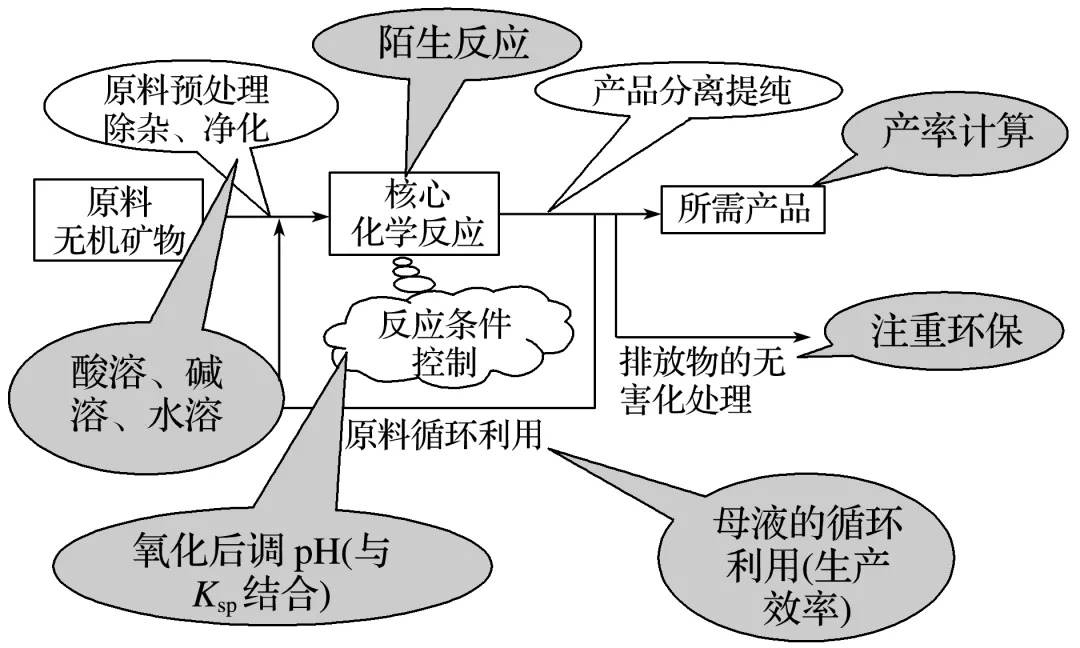
二、工业流程题分类突破
题型一 物质制备类化工流程题
1.核心反应——陌生方程式的书写
关注箭头的指向:箭头指入→反应物,箭头指出→生成物。
(1)氧化还原反应:熟练应用氧化还原规律,①判断产物,②根据化合价升降相等配平。
(2)非氧化还原反应:结合物质性质和反应实际判断产物。
2.原料的预处理
(1)溶解:通常用酸溶。如用硫酸、盐酸等。
水浸 | 与水接触反应或溶解 |
浸出 | 固体加水(酸)溶解得到离子 |
酸浸 | 在酸溶液中反应,使可溶性金属离子进入溶液,不溶物通过过滤除去的溶解过程 |
浸出率 | 固体溶解后,离子在溶液中的含量的多少(更多转化) |
(2)灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解。
(3)审题时要“瞻前顾后”,注意物质性质及反应原理的前后联系。
3.常用的控制反应条件的方法
(1)调节溶液的pH。常用于使某些金属离子形成氢氧化物沉淀。调节pH所需的物质一般应满足两点:
①能与H+反应,使溶液pH增大;
②不引入新杂质。
例如:若要除去Cu2+中混有的Fe3+,可加入CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH,不可加入NaOH溶液、氨水等。
(2)控制温度。根据需要升温或降温,改变反应速率或使平衡向需要的方向移动。
(3)趁热过滤。防止某物质降温时会析出。
(4)冰水洗涤。洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
【典例1】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
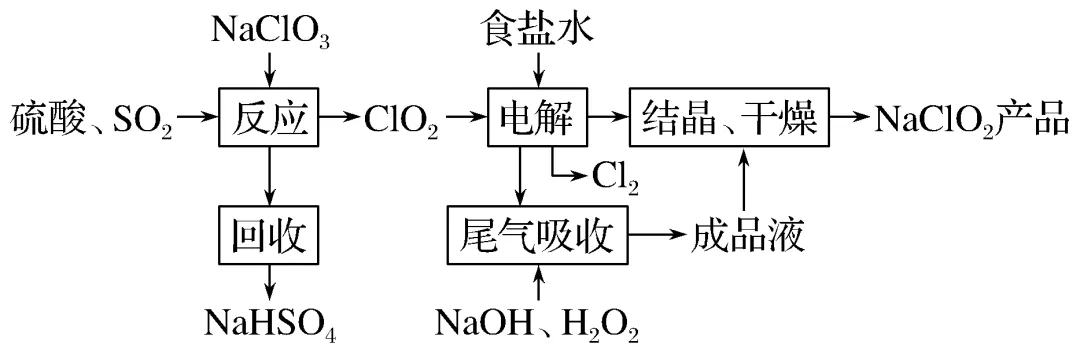
回答下列问题:
(1)NaClO2中Cl的化合价为________。
(2)写出“反应”步骤中生成ClO2的化学方程式______________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为______,该反应中氧化产物是________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________。(计算结果保留两位小数)
【破解思路】
第一步:读题目,明确目的——制备NaClO2
第二步:审流程,分块破题——拆分工艺流程
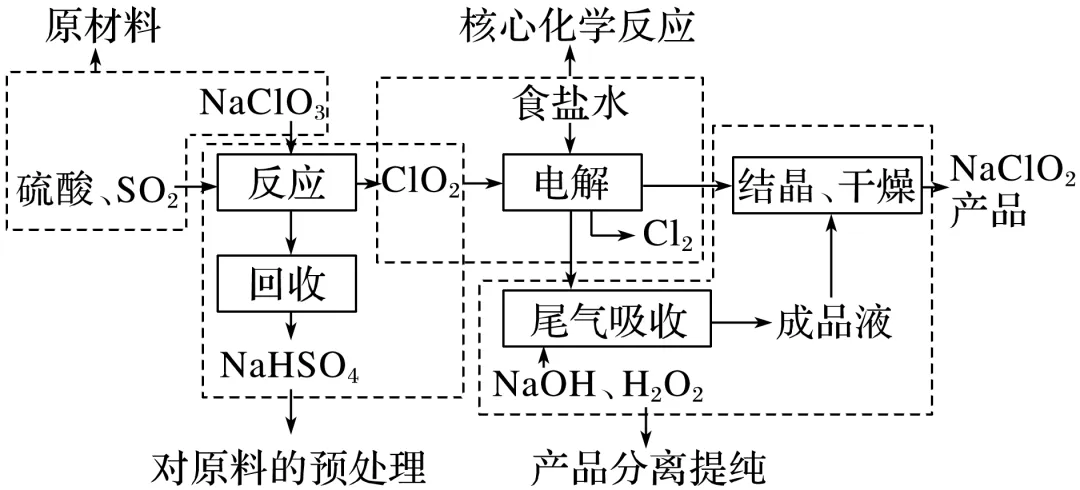
第三步:看设问,结合题中的问题,回到流程图中找【答案】。
【抠分秘笈】
(1)设问一般相对独立,无连带效应,一个问题解决不了不会影响下一个问题的解决。
(2)题中基本上都有与流程无关的问题,可直接作答;对于超纲知识,题目中要么有信息提示,要么与解答题目无关。
【答案】 (1)+3 (2)2NaClO3+H2SO4+SO2===2NaHSO4+2ClO2
(3)NaOH溶液 Na2CO3溶液 ClO-2(或NaClO2) (4)2∶1 O2 (5)1.57
题型二 提纯类化工流程题
1.明确常用的提纯方法
(1)水溶法:除去可溶性杂质。
(2)酸溶法:除去碱性杂质。
(3)碱溶法:除去酸性杂质。
(4)氧化剂或还原剂法:除去还原性或氧化性杂质。
(5)加热灼烧法:除去受热易分解或易挥发的杂质。
(6)调节溶液的pH法:如除去酸性溶液中的Fe3+等。
2.明确常用的分离方法
(1)过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法。
(2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴。
(3)蒸发结晶:提取溶解度随温度变化不大的溶质,如NaCl。
(4)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。
(5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇或甘油。
(6)冷却法:利用气体液化的特点分离气体,如合成氨工业采用冷却法分离平衡混合气体中的氨气。
【典例2】高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
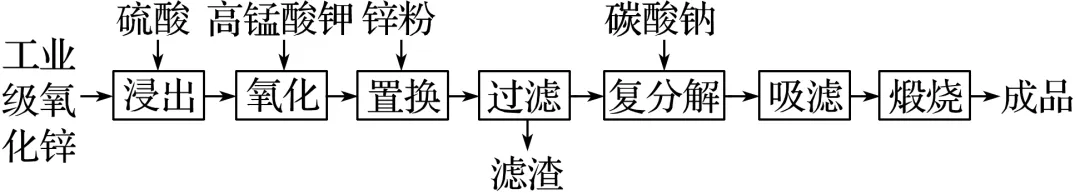
已知Ksp[Fe(OH)3]=4.0×10-38 mol4·L-4。
回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写两种): ____________。
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:
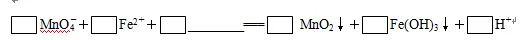
(3)加入锌粉的目的是______________________________。
(4)已知H2SO4浸出液中,[Fe2+]=5.04 mg·L-1、[Mn2+]=1.65 mg·L-1。
①加入KMnO4溶液反应一段时间后,溶液中[Fe3+]=0.56 mg·L-1,若溶液pH=3,则此时Fe3+________(填“能”或“不能”)生成沉淀。
②若要除尽1 m3上述浸出液中的Fe2+和Mn2+,需加入________ g KMnO4。
【解析】 (1)为了提高浸出效率,可以适当增大硫酸浓度、搅拌、将固体粉碎、提高浸出温度等。
(2)锰元素由+7价降低到+4价,而铁元素由+2价升高到+3价,根据得失电子守恒、原子守恒和电荷守恒配平方程式。
(3)加入锌粉的目的是消耗溶液中的H+,调节溶液pH,促进溶液中的Cu2+、Ni2+、Cd2+等形成沉淀而除去。

【答案】 (1)将工业级氧化锌粉碎、搅拌,增大硫酸浓度(其他合理【答案】也可)
(2)1 3 7 H2O 1 3 5
(3)调节溶液pH,除去溶液中的Cu2+、Ni2+、Cd2+等
(4)①不能 ②7.9
热点精练
1.硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
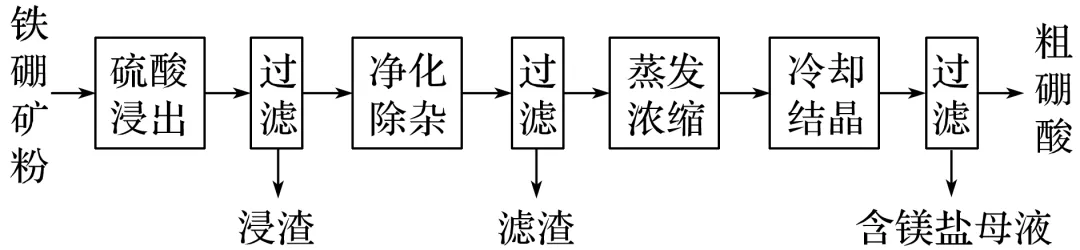
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式___________________。
为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有_________(写出两条)。
(2)利用________的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是________(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是____________________________。然后再调节溶液的pH约为5,目的是__________________________________。
(4)“粗硼酸”中的主要杂质是________(填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_。
(6)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程: _____________。
【答案】 (1)Mg2B2O5·H2O+2H2SO4△2MgSO4+2H3BO3 提高反应温度、减小铁硼矿粉粒径
(2)Fe3O4 SiO2和CaSO4
(3)将Fe2+氧化为Fe3+ 使Al3+和Fe3+形成氢氧化物沉淀而除去
(4)(七水)硫酸镁 (5)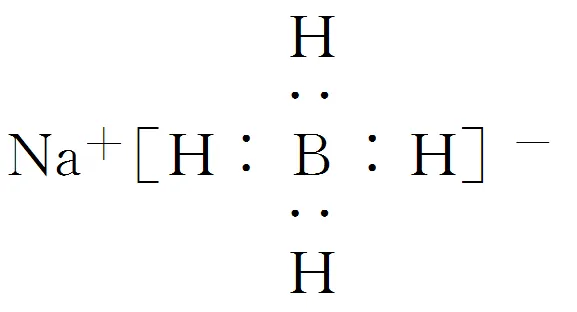
(6)2H3BO3△B2O3+3H2O、B2O3+3Mg △2B+3MgO
【解析】 (1)Mg2B2O5·H2O与硫酸反应生成H3BO3、MgSO4,配平即可。为提高浸出速率,可以从温度(升高温度)、浓度、增大接触面积(将矿石粉碎)等角度分析。(2)Fe3O4具有磁性,可以利用铁块将其从“浸渣”中吸出。SiO2不溶于H2SO4,CaO与H2SO4生成CaSO4微溶于水,所以“浸渣”中还有SiO2和CaSO4。此时溶液中除H3BO3外还有MgSO4[由(1)中反应生成]、Fe2(SO4)3、FeSO4、Al2(SO4)3。(3)“净化除杂”先加H2O2的目的是将Fe2+氧化为Fe3+,然后再通过调节pH促进Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀而除去。
(4)“粗硼酸”中的主要杂质是没有被除去的MgSO4。
(5)NaBH4由Na+和BH-4组成。其中的氢显-1价,-1价的H具有较强的还原性。(6)以硼酸和金属镁为原料制备单质硼的过程:H3BO3分解生成B2O3,B2O3与金属镁发生置换反应生成单质B。
2.软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
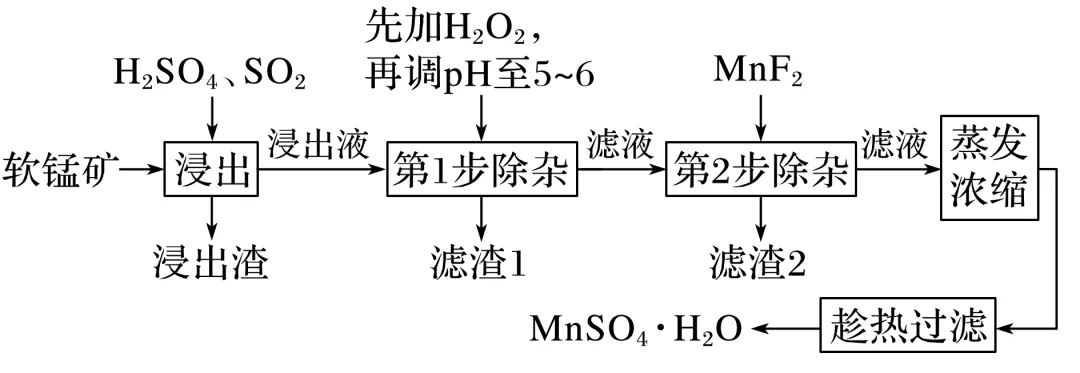
已知:①部分金属阳离子完全沉淀时的pH如下表
金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
完全沉淀时的pH | 3.2 | 5.2 | 10.4 | 12.4 |
②温度高于27 ℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为________。
(2)第1步除杂中加入H2O2的目的是_______________________。
(3)第1步除杂中形成滤渣1的主要成分为________(填化学式),调pH至5~6所加的试剂,可选择________(填以下试剂的序号字母)。
a.CaOb.MgO c.Al2O3d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式: _____________________,该反应的平衡常数数值为________。
(已知:MnF2的Ksp=5.3×10-3 mol3·L-3;CaF2的Ksp=1.5×10-10 mol3·L-3;MgF2的Ksp=7.4×10-11 mol3·L-3)
(5)采用“趁热过滤”操作的原因是______________________。
(6)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是______(用离子方程式表示)。
【答案】 (1)MnO2+SO2===SO2-4+Mn2+
(2)将Fe2+氧化为Fe3+
(3)Al(OH)3、Fe(OH)3 ab
(4)MnF2+Mg2+ Mn2++MgF2 7.2×107
Mn2++MgF2 7.2×107
(5)减少MnSO4·H2O在水中的溶解,得到更多产品
(6)Mn2++2H2O Mn(OH)2+2H+
Mn(OH)2+2H+
【解析】 (1)“浸出”过程中MnO2与SO2发生氧化还原反应,离子方程式为MnO2+SO2===SO2-4+Mn2+。
(2)第1步除杂中加入H2O2的目的是将溶液中的Fe2+氧化为Fe3+,以便于形成Fe(OH)3沉淀,过滤将沉淀除去。
(3)第1步除杂时调整溶液的pH在5~6,可以使溶液中的Al3+、Fe3+分别形成Al(OH)3、Fe(OH)3沉淀,所以形成滤渣1的主要成分为Al(OH)3、Fe(OH)3;在调pH至5~6时,为了不引入新的杂质离子,所加的试剂应该可以与酸发生反应,可选择含有Ca2+、Mg2+的化合物CaO、MgO,a、b正确。
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应的氟化物沉淀除去,MnF2除去Mg2+的离子反应方程式是MnF2+Mg2+Mn2++MgF2;该反应的平衡常数K=[Mn2+][Mg2+]=[Mn2+][F-]2[Mg2+][F-]2=Ksp(MnF2)Ksp(MgF2)≈7.2×107。
(5)由已知②温度高于27 ℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低,故采用“趁热过滤”操作可以减少MnSO4·H2O在水中的溶解,得到更多产品。
(6)MnSO4是强酸弱碱盐,Mn2+发生水解反应。
3.以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废矾催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
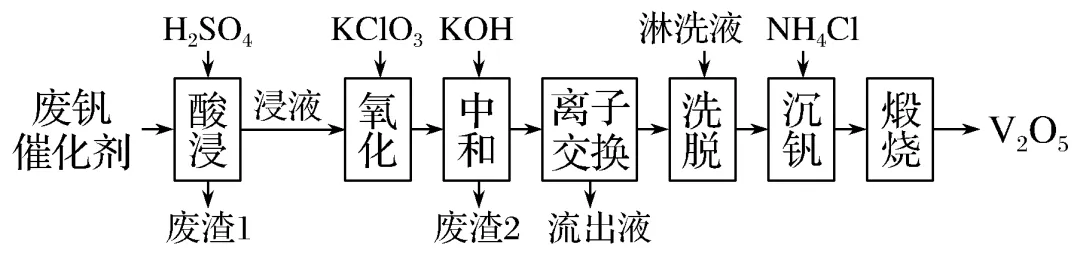
回答下列问题:
(1)“酸浸”时V2O5转化为VO+2,反应的离子方程式为__________,同时V2O4转化成VO2+。“废渣1”的主要成分是________。
(2)“氧化”中欲使3 mol的VO2+变为VO+2,则需要氧化剂KClO3至少为________ mol。
(3)“中和”作用之一是使钒以V4O4-12形式存在于溶液中。“废渣2”中含有________。
(4)“离子交换”和“洗脱”可简单表示为4ROH+V4O4-12离子交换洗脱R4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈________性(填“酸”“碱”或“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式_____。
【答案】 (1)V2O5+2H+===2VO+2+H2O SiO2
(2)0.5 (3)Fe(OH)3、Al(OH)3 (4)碱 (5)K+
(6)2NH4VO3高温V2O5+H2O↑+2NH3↑
【解析】 (1)“酸浸”时V2O5转化为VO+2,前后V元素化合价不变,说明没有发生氧化还原反应,则反应的离子方程式为V2O5+2H+===2VO+2+H2O。由于SiO2与H2SO4不反应,故“废渣1”的主要成分为SiO2。(2)VO2+变为VO+2,V的化合价由+4价升高到+5价,转移1e-,而氧化剂KClO3则被还原为KCl,化合价由+5价降低为-1价,转移6e-,故欲使3 mol VO2+变为VO+2,需氧化剂KClO3的物质的量至少为3 mol×1÷6=0.5 mol。
(3)酸浸并用KClO3氧化后的溶液中含有的Fe3+、Al3+,在“中和”时生成Fe(OH)3、Al(OH)3沉淀,所以“废渣2”中含有Fe(OH)3、Al(OH)3。(4)由题意知逆反应是“洗脱”,在碱性环境中有利于向“洗脱”方向进行,故淋洗液应呈碱性。(5)由于前面加入了KClO3、KOH,所以“流出液”中阳离子最多的是K+。(6)根据原子守恒可知偏钒酸铵“煅烧”生成五氧化二钒、氨气和水蒸气,发生反应的化学方程式为2NH4VO3高温V2O5+H2O↑+2NH3↑。
为便于友友们阅读,现将各个合集的代表作展示如下,欢迎赐教:
(1)《氧化还原反应》合集:热点梳理:有关氧化还原反应的热考点
(2)《物质的量》合集:雾点警示:你知道摩尔命题有哪些魔坑吗
(3)《物质结构、元素周期律》合集:【克难秘技】巧解晶体投影、妙定粒子坐标
(4)《电化学》合集:“四步曲”搞定新情境下原电池电极反应式的书写
(5)《化学平衡、化学反应速率》合集:【同步教辅】《化学反应原理》专题复习之《化学平衡综合应用》
(6)《电解质溶液》合集:重点明示:有关弱电解质的三大考点
(7)《化学实验》合集:热点提升:常见两类实验,破解设计方案
(8)《有机化学》合集:热点专攻:如何巧解有机合成综合题
(9)《我的育人理念》合集:考后寄语:高考,人生的跳板而已
(10)《我的文学作品》合集:周末驿站:那个中午,我收到了3封情书
(11)《诗歌》合集:教师节抒怀诗词两首
特别提示:点击“合集”(操作方法见精选文章《本公众号使用说明书》)可以得到某合集所有考点的word版。


百度网盘:【热点提升】无机化工流程题的破解策略(可下载word版).docx
链接: https://pan.baidu.com/s/1-CzKGaJcqOZPXZgaQsBygQ
提取码: 5521