
 年天津市普通高中学业水平等级性考试
年天津市普通高中学业水平等级性考试
化学
本试卷分为第I卷(选择题)和第II卷(非选择题)两部分,共100分,考试用时60分钟。第I卷1至4页,第II卷5至8页。
答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上,并在规定位置粘贴考试用条形码。答卷时,考生务必将答案涂写在答题卡上,答在试卷上的无效。考试结束后,将本试卷和答题卡一并交回。
以下数据可供解题时参考:相对原子质量:H 1C 12O 16Na 23
第I卷
注意事项:
1.每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
2.本卷共12题,每题3分,共36分。在每题所给出的四个选项中,只有一项是最符合题目要求的。
1. 近年我国在科技领域不断取得新成就。对相关成就所涉及的化学知识理解错误的是
A. 我国科学家实现了从二氧化碳到淀粉 人工合成,淀粉是一种单糖
人工合成,淀粉是一种单糖
B. 中国“深海一号”平台成功实现从深海中开采石油和天然气,石油和天然气都是混合物
C. 我国实现了高性能纤维锂离子电池的规模化制备,锂离子电池放电时将化学能转化为电能
D. 以硅树脂为基体的自供电软机器人成功挑战马里亚纳海沟,硅树脂是一种高分子材料
2. 嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是
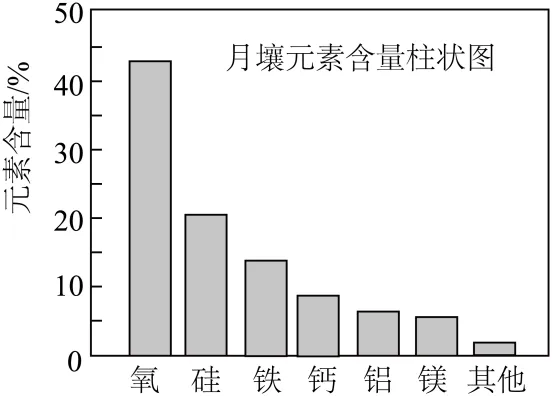
A. 原子半径:Al<SiB. 第一电离能:Mg<Ca
C. Fe位于元素周期表的p区D. 这六种元素中,电负性最大的是O
3. 下列物质沸点的比较,正确的是
A. 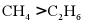 B. HF>HCl
B. HF>HCl
C. 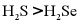 D.
D. 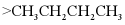
4. 利用反应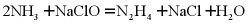 可制备N2H4。下列叙述正确的是
可制备N2H4。下列叙述正确的是
A. NH3分子有孤电子对,可做配体
B. NaCl晶体可以导电
C. 一个N2H4分子中有4个σ键
D. NaClO和NaCl均为离子化合物,他们所含的化学键类型相同
5. 燃油汽车行驶中会产生CO、NO等多种污染物。下图为汽车发动机及催化转化器中发生的部分化学反应。以下判断错误的是
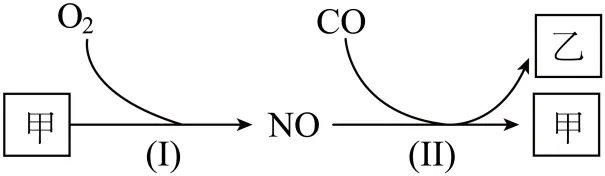
A. 甲是空气中体积分数最大的成分B. 乙是引起温室效应的气体之一
C. 反应(Ⅰ)在常温下容易发生D. 反应(Ⅱ)中NO是氧化剂
6. 向恒温恒容密闭容器中通入2mol 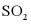 和1mol
和1mol 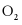 ,反应
,反应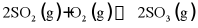 达到平衡后,再通入一定量
达到平衡后,再通入一定量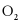 ,达到新平衡时,下列有关判断错误的是
,达到新平衡时,下列有关判断错误的是
A. 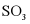 的平衡浓度增大B. 反应平衡常数增大
的平衡浓度增大B. 反应平衡常数增大
C. 正向反应速率增大D. 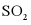 的转化总量增大
的转化总量增大
7. 下列关于苯丙氨酸甲酯的叙述,正确的是
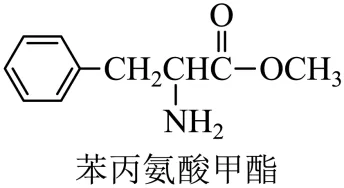
A. 具有碱性B. 不能发生水解
C. 分子中不含手性碳原子D. 分子中采取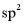 杂化的碳原子数目为6
杂化的碳原子数目为6
8. 25℃时,下列各组离子中可以在水溶液中大量共存的是
A.  、
、 、
、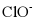 、
、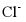 B.
B. 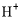 、
、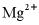 、
、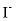 、
、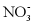
C. 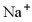 、
、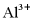 、
、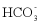 、
、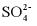 D.
D. 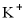 、
、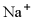 、
、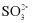 、
、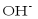
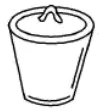
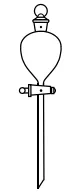
9. 下列实验操作中选用仪器正确 是
是

| 
| 
| 
|
用量筒量取10.00mL盐酸 | 用瓷坩埚加热熔化NaOH固体 | 用分液漏斗分离乙酸异戊酯和水的混合物 | 配制一定温度的NaCl饱和溶液,用温度计测温并搅拌 |
A | B | C | D |
A. AB. BC. CD. D
10. 下列叙述错误的是
A. 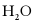
 极性分子
极性分子
B. 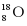 原子的中子数为10
原子的中子数为10
C. 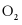 与
与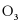 互为同素异形体
互为同素异形体
D. 和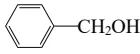 互为同系物
互为同系物
11. 实验装置如图所示。接通电源后,用碳棒(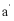 、
、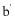 )作笔,在浸有饱和NaCl溶液和石蕊溶液的湿润试纸上同时写字,
)作笔,在浸有饱和NaCl溶液和石蕊溶液的湿润试纸上同时写字,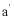 端的字迹呈白色。下列结论正确的是
端的字迹呈白色。下列结论正确的是
A. a为负极
B.  端
端 字迹呈蓝色
字迹呈蓝色
C. 电子流向为:
D. 如果将 、
、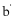 换成铜棒,与碳棒作电极时的现象相同
换成铜棒,与碳棒作电极时的现象相同
12. 一定条件下,石墨转化为金刚石吸收能量。下列关于石墨和金刚石的说法正确的是
A. 金刚石比石墨稳定
B. 两物质的碳碳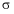 键的键角相同
键的键角相同
C. 等质量的石墨和金刚石中,碳碳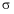 键数目之比为4∶3
键数目之比为4∶3
D 可以用X射线衍射仪鉴别金刚石和石墨
可以用X射线衍射仪鉴别金刚石和石墨
第II卷
13. 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为___________。
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式: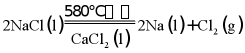 ,加入
,加入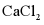 的目的是___________。
的目的是___________。
(3)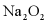 的电子式为___________。在25℃和101kPa时,Na与
的电子式为___________。在25℃和101kPa时,Na与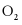 反应生成1mol
反应生成1mol 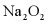 放热510.9kJ,写出该反应的热化学方程式:___________。
放热510.9kJ,写出该反应的热化学方程式:___________。
(4)采用空气和Na为原料可直接制备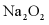 。空气与熔融金属Na反应前需依次通过___________、___________(填序号)
。空气与熔融金属Na反应前需依次通过___________、___________(填序号)
a.浓硫酸b.饱和食盐水c.NaOH溶液d.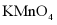 溶液
溶液
(5)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为___________。
(6)天然碱的主要成分为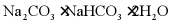
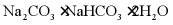 经充分加热得到
经充分加热得到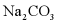 的质量为___________g。
的质量为___________g。
14. 光固化是高效、环保、节能的材料表面处理技术。化合物E是一种广泛应用于光固化产品的光引发剂,可采用异丁酸(A)为原料,按如图路线合成:
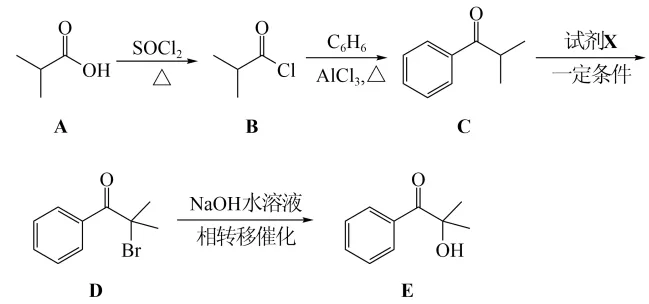
回答下列问题:
(1)写出化合物E的分子式:___________,其含氧官能团名称为___________。
(2)用系统命名法对A命名:___________;在异丁酸的同分异构体中,属于酯类的化合物数目为___________,写出其中含有4种处于不同化学环境氢原子的异构体的结构简式:___________。
(3)为实现C→D的转化,试剂X为___________(填序号)。
a.HBrb.NaBrc.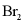
(4)D→E的反应类型为___________。
(5)在紫外光照射下,少量化合物E能引发甲基丙烯酸甲酯(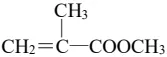 )快速聚合,写出该聚合反应的方程式:___________。
)快速聚合,写出该聚合反应的方程式:___________。
(6)已知: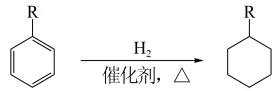 R=烷基或羧基
R=烷基或羧基
参照以上合成路线和条件,利用甲苯和苯及必要的无机试剂,在方框中完成制备化合物F的合成路线。___________

15. 氯化铁是重要的化工原料。针对氯化铁的实验室制备方法,回答下列问题:
Ⅰ.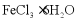 的制备
的制备
制备流程图如下:
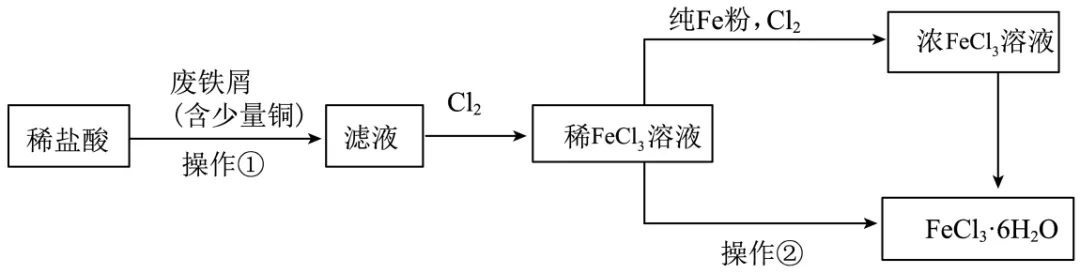
(1)将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为___________。含有少量铜的废铁屑比纯铁屑反应快,原因为___________。
(2)操作①所必需的玻璃仪器中,除烧杯外还有___________。
(3)检验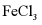 溶液中是否残留
溶液中是否残留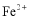 的试剂是___________。
的试剂是___________。
(4)为增大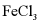 溶液的浓度,向稀
溶液的浓度,向稀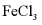 溶液中加入纯Fe粉后通入
溶液中加入纯Fe粉后通入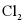 。此过程中发生的主要反应的离子方程式为___________。
。此过程中发生的主要反应的离子方程式为___________。
(5)操作②为___________。
Ⅱ.由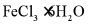 制备无水
制备无水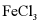
将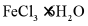 与液体
与液体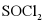 混合并加热,制得无水
混合并加热,制得无水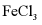 。已知
。已知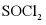 沸点为77℃,反应方程式为:
沸点为77℃,反应方程式为: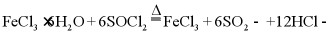 ,装置如下图所示(夹持和加热装置略)。
,装置如下图所示(夹持和加热装置略)。
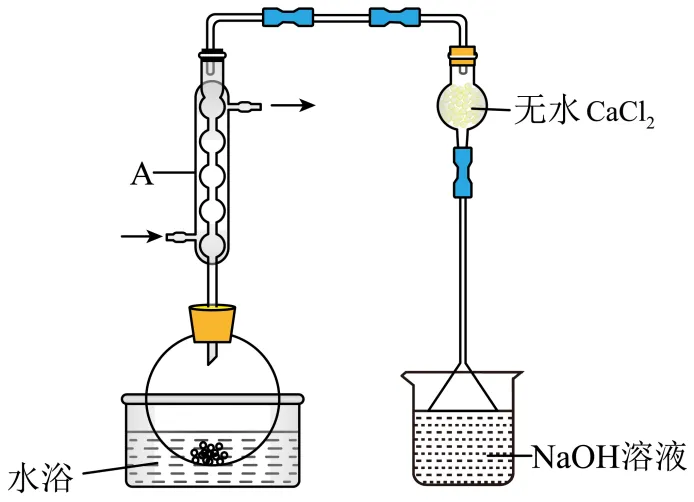
(6)仪器A的名称为___________,其作用为___________。NaOH溶液的作用是___________。
(7)干燥管中无水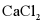 不能换成碱石灰,原因是___________。
不能换成碱石灰,原因是___________。
(8)由下列结晶水合物制备无水盐,适宜使用上述方法的是___________(填序号)。
a.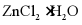 b.
b.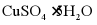 c.
c.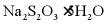
16. 天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物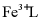 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体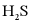 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①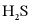 的吸收氧化;②
的吸收氧化;②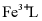 的再生。反应原理如下:
的再生。反应原理如下:
①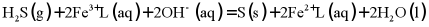
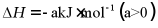
②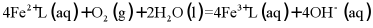
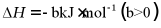
回答下列问题:
(1)该工艺的总反应方程式为___________。1mol 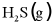 发生该反应的热量变化为___________,在总反应中的作用是___________。
发生该反应的热量变化为___________,在总反应中的作用是___________。
(2)研究不同配体与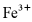 所形成的配合物(A、B、C)对
所形成的配合物(A、B、C)对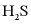 吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入
吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入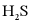 ,测得单位体积吸收液中
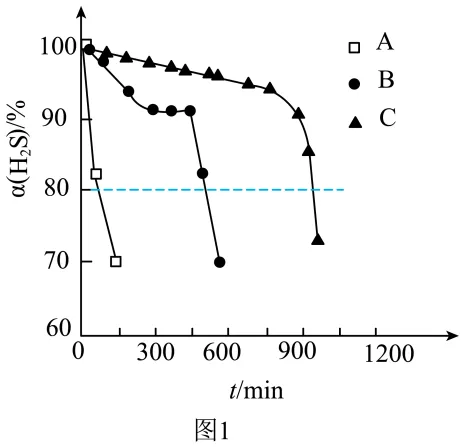
,测得单位体积吸收液中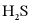 吸收转化率
吸收转化率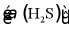 随时间变化的曲线如图1所示。以
随时间变化的曲线如图1所示。以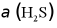 由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是___________(填“A”、“B”或“C”)。
由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是___________(填“A”、“B”或“C”)。
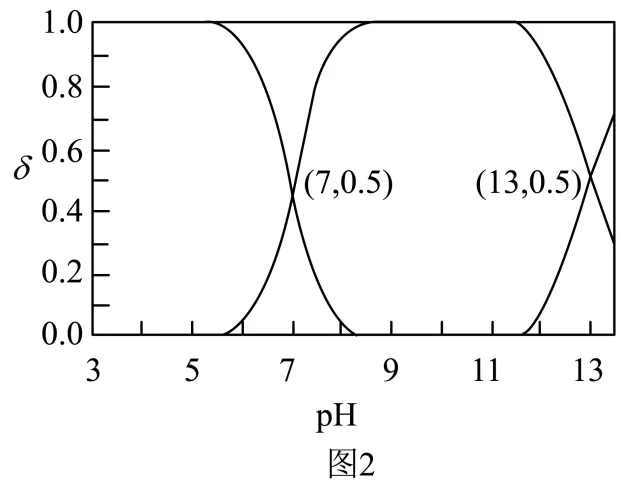
(3)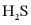 的电离方程式为___________。25℃时,
的电离方程式为___________。25℃时,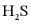 溶液中
溶液中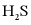 、
、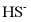 、
、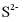 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数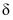 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算,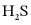 的
的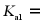 ___________,___________。再生反应在常温下进行,
___________,___________。再生反应在常温下进行,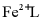 解离出的
解离出的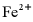 易与溶液中的
易与溶液中的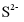 形成沉淀。若溶液中的
形成沉淀。若溶液中的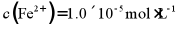 ,为避免有FeS沉淀生成,应控制溶液pH不大于___________(已知25℃时,FeS的
,为避免有FeS沉淀生成,应控制溶液pH不大于___________(已知25℃时,FeS的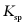 为
为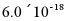 )。
)。



通过网盘分享的文件:【免费下载】2022年高考化学试卷(天津)(空白卷)省市高考真题电子版word含解析答案学生教师版
链接: https://pan.baidu.com/s/1Jy3LodUgE3Q24aPt0c8Bjw?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享