
2025年天津市普通高中学业水平等级性考试
化学
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试用时60分钟。第Ⅰ卷1至4页,第Ⅱ卷5至6页,共100分。
答卷前,考生务必将自己的姓名、准考号填写在答题卡上,并在规定位置粘贴考试用条形码。答卷时,考生务必将答案涂写在答题卡上,答在试卷上的无效。考试结束后,将本试卷和答题卡一并交回。
祝各位考生考试顺利!
第Ⅰ卷
注意事项:
1.每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
2.本卷共12题,每题3分,共36分。在每题列出的四个选项中,只有一项是最符合题目要求的。
1. 天津位于渤海之滨,地处“九河下梢”,因河而生,向海而兴,自古流传着“精卫填海”“哪吒闹海”等传说,其海水资源丰富,下列说法错误的是
A. 海水可经蒸馏制备淡水
B. 海水经氯气氧化可直接得到液溴
C. 海水晒盐的过程涉及溶液的蒸发、结晶
D. 用离子交换膜法电解饱和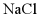 溶液可得到烧碱溶液
溶液可得到烧碱溶液
2. 下列可用作食品添加剂且属于无机物的是
A. 硫酸铅B. 木糖醇C. 葡萄糖酸-δ-内酯D. 二氧化硫
3. 下列离子在溶液中能大量共存的是
A. 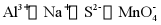 B.
B. 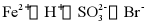
C. 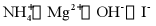 D.
D. 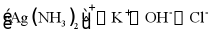
4. 下列比较结果,错误的是
A. 熔点:石英>苯酚
B. 热稳定性: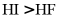
C. 离子半径: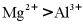
D. 分散系中分散质粒子的直径: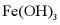 胶体
胶体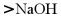 溶液
溶液
5. 下列叙述和反应方程式相对应且正确的是
A. 实验室制备氨气: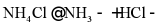
B. 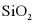 与盐酸反应:
与盐酸反应: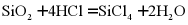
C. 常温下,将氯气通入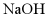 溶液中:
溶液中: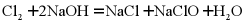
D. 氯化亚铁溶液中加入稀硝酸: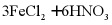 (稀)
(稀)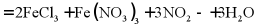
6. 仪器分析在化学研究中有重要应用。下列方法选择错误的是
A. 用pH计区分KCl溶液和NaNO3溶液B. 用X射线衍射法区分玻璃和蓝宝石
C. 用原子光谱鉴定样品中含有元素LiD. 用质谱区分正己醇和正庚醇
7. 利用反应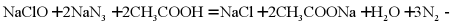 可处理
可处理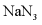 。设
。设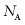 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A. 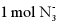 中含有的电子数目为
中含有的电子数目为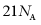
B. 消耗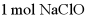 ,生成
,生成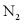
 体积为67.2 L
体积为67.2 L
C. 处理6.5 g NaN3,至少需要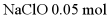
D. 处理1 mol NaN3,反应转移的电子数目为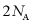
8. 油脂、淀粉、纤维素和蛋白质是重要的物质。下列说法错误的是
A. 油脂为高级脂肪酸的甘油酯,属于高分子化合物
B. 油脂、淀粉、纤维素和蛋白质均可发生水解反应
C. 蛋白质是由多种氨基酸通过肽键等相互连接形成的有机分子
D. 淀粉和纤维素的分子式均可表示为(C6H10O5)n,二者结构不同
9. 依据下列实验操作及现象,不能得出相应结论的是
| 实验操作及现象 | 结论 |
A | 将稀盐酸滴入NaHCO3溶液中,产生 气体通入澄清的石灰水,石灰水变浑浊 气体通入澄清的石灰水,石灰水变浑浊 | 非金属性:Cl>C |
B | 硫化锌(ZnS,白色)、硫化镉(CdS,黄色)为难溶电解质。向浓度均为0.1 mol/L的Zn2+、Cd2+混合液中,滴加Na2S稀溶液,先出现的沉淀是黄色的 | 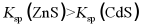
|
C | 向可能含有Fe2+的未知溶液中,滴加1滴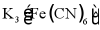 溶液,有特征蓝色沉淀生成 溶液,有特征蓝色沉淀生成 | 原未知溶液中含有Fe2+ |
D | 向含有新制的氢氧化铜的碱性溶液中,加入乙醛溶液并加热,出现砖红色沉淀 | 乙醛具有还原性 |
A. AB. BC. CD. D
10. 我国科学家报道了如下反应。
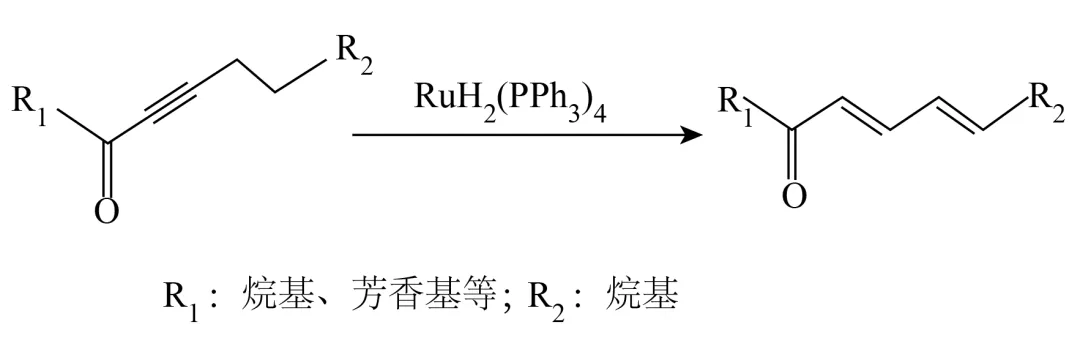
有关该反应的说法错误的是
A. 反应物与产物的摩尔质量相同
B. 反应物与产物的红外光谱相同
C. 反应物与产物均能使酸性高锰酸钾溶液褪色
D. 反应过程中有碳氢键的断裂和碳碳双键的形成
11. 下图是简易量热计装置示意图,下列反应的反应热不适宜用该装置测定的是
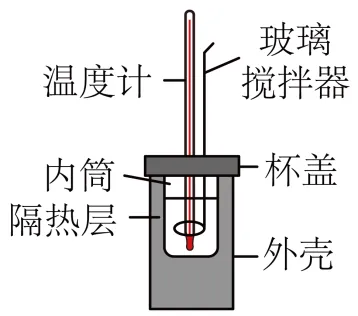
A. BaO和足量的水B. Al和足量的NaOH溶液
C. ZnO和足量的稀硫酸D. KOH溶液和足量的稀盐酸
12. 苹果酸是二元弱酸,以H2A表示,常用于制造药物、糖果等。25℃时,溶液中H2A、HA-和A2-的分布系数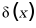 随溶液pH变化如图。
随溶液pH变化如图。
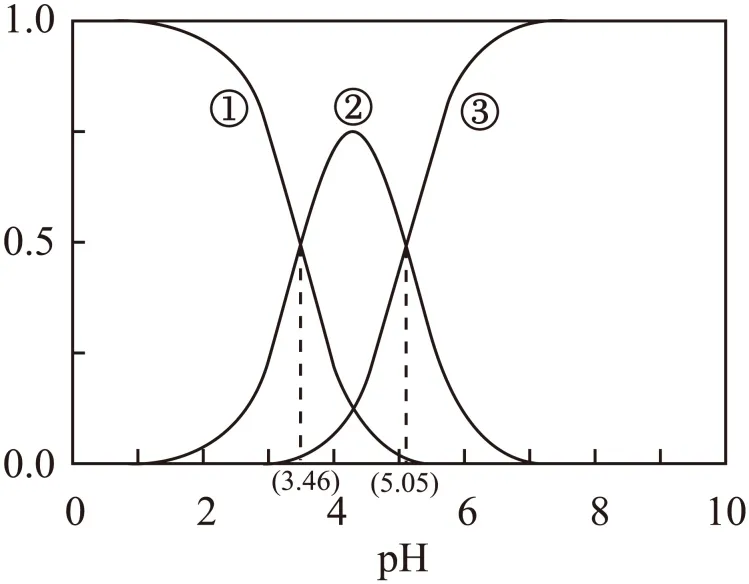
例如:A2-的分布系数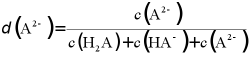
该温度下,下列说法错误的是
A. 曲线①是H2A的分布系数曲线
B. H2A的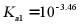
C. 反应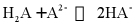 的平衡常数
的平衡常数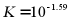
D. pH=6时,溶液中粒子浓度的大小关系为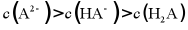
机密★启用前
2025年天津市普通高中学业水平等级性考试
化学
第Ⅱ卷
注意事项:
1.用黑色墨水的钢笔或签字笔将答案填写在答题卡上。
2.本卷共4题,共64分。
13. 硫是一种重要的非金属元素。
(1)基态S原子的价层电子的轨道表示式为___________。H2S的VSEPR模型名称为___________,其空间结构为___________。
(2)H2O、H2S、H2Se的沸点由高到低的顺序为___________。
(3)NH4HS的电子式为___________。在25℃和101 kPa下,NH3与H2S两种气体反应生成1 mol NH4HS固体时,放出90.4 kJ的热量,该反应的热化学方程式为___________。
(4)25℃时,H2S的Ka1和Ka2分别为1.1×10-7、1.3×10-13,NH3·H2O的Kb为1.8×10-5,则NH4HS水溶液显___________(填“酸性”“中性”“碱性”)。
(5)硫化锂晶体的晶胞如图,晶胞中含有硫离子的数目为___________;与硫离子最近且距离相等的锂离子的数目为___________。
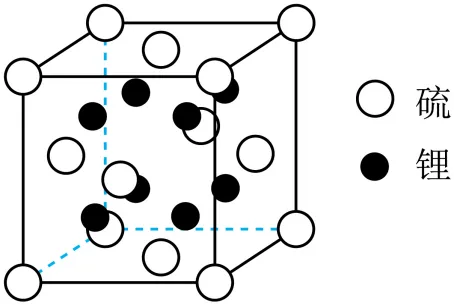
(6)将1.0 g硫粉和2.0 g铁粉均匀混合,放在陶土网上堆成条状。用灼热的玻璃棒触及混合粉末的一端引发反应,反应剧烈。实验中可能发生的反应为_________(用化学方程式表示)。
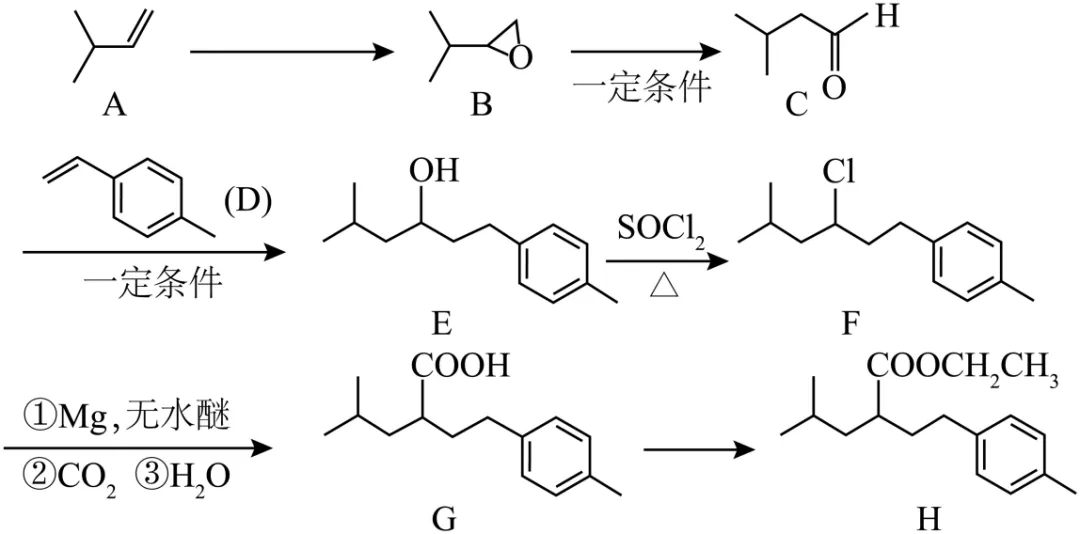
14. 我国学者报道了一种制备醇的新方法,其合成及进一步转化为化合物H的反应路线如下所示。
已知: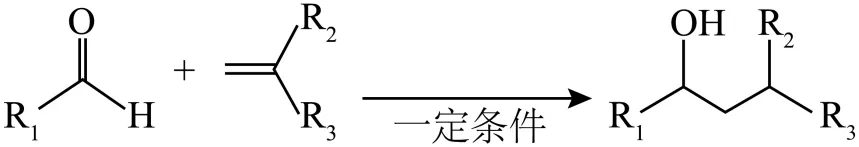
R1:烷基、芳香基;R2:芳香基、烷基、H;R3:芳香基、烷基
(1)A→B的反应试剂及条件为___________。
(2)B的含有碳氧双键的同分异构体数目为___________(不考虑立体异构)。
(3)C的系统命名法的名称为___________,其核磁共振氢谱有_____组吸收峰。
(4)D中最多共平面原子数目为___________。
(5)E中官能团 名称为___________,含有的手性碳原子数目为___________。
名称为___________,含有的手性碳原子数目为___________。
(6)E→F的反应类型为___________。
(7)G→H的反应方程式为___________。
(8)以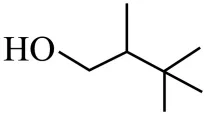 及题干中的有机化合物为原料(无机试剂任选),参考所给反应路线及条件,完成下列目标化合物的合成___________。
及题干中的有机化合物为原料(无机试剂任选),参考所给反应路线及条件,完成下列目标化合物的合成___________。

15. 硫酸铜铵可用作杀虫剂等,其晶体组成可表示为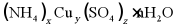 。某学习小组为探究其组成进行了如下实验。
。某学习小组为探究其组成进行了如下实验。
Ⅰ.溶液的配制


通过网盘分享的文件:【免费下载】高考真题【天津】2025年天津高考真题化学试题(原卷版)word版含解析学生版教师版
链接: https://pan.baidu.com/s/1jRkPGeOTBE3Fc4rkn10ATA?pwd=4321 提取码: 4321
--来自百度网盘超级会员v8的分享